Обзор процесса изобретения новых лекарств

В настоящий момент я пытаюсь проиллюстрировать, как в идущем в ногу со временем мире случается исследование медицинского препарата. Тут мы видим ряд рубежей, которые нужно пройти особому веществу, до того как оно будет медицинским препаратом.
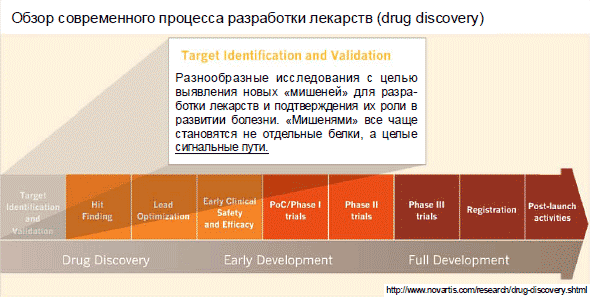
Наконец, 1-ый шаг исследования медицинские препараты — выбор подходящей мишени, на которую данное медицинский препарат (вещество) станет работать. Таковой мишенью быть может точный белок. Нередко таковой мишенью считается не столько точный белок, а целый сигнальный каскад.

В последствии того, как подобрана цель, вторым шагом считается нахождение так именуемых бестселлеров — которые в вашей тест-системе, в вашей пробирке проявляют способность ингибировать данный белок-мишень. Данный шаг нахождения бестселлеров содержит исследование верной тест-системы, которая воплощает в жизнь высокопроизводительный скрининг препаратов. Из этого можно сделать вывод, собственно у вас есть 50 тысяч-1 миллион различных хим препаратов — и вы представляете, собственно из числа данных препаратов есть одно или же 2, которые готовы исполнять нужную вам функцию, а конкретно ингибировать ваш белок-мишень. Дабы сыскать в данном стоге сена подходящую соломинку, вы должны создать тест-систему, коя дозволит вам высокопроизводительно проскринировать эти все препараты.

Грядущим рубежом считается оптимизация таковых lead-compounds. Вы сыскали вещество, которое in vitro, в лабораторных критериях, на самом деле способно уничтожать активность явного белка, который слишком активен в предопределенной форме рака. Чтобы доказать, вы должны выяснить его влияние на наиболее трудоемких моделях. Вы должны удостовериться, собственно данное вещество, попадая, к примеру, в кровь больного, не станет его убивать неспецифически – либо не станет распадаться с ужасной скоростью и следовательно не станет способно скрупулезно исполнять роль медицинского препарата.
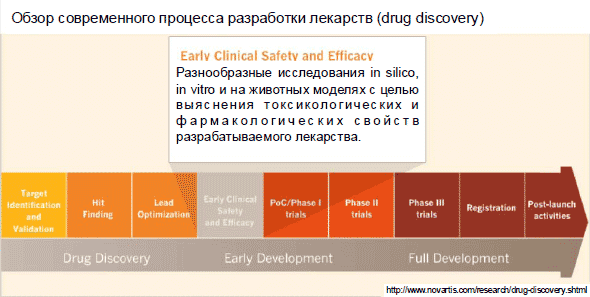
Допустим, вы прошли данный шаг и и уже готовы к тому, дабы перейти к изысканию данного препараты на животных моделях. Природно, прежде нежели предоставлять данное вещество больному, человеку, вы должны удостовериться, как оно действует на животных (мыши, зайчики, собаки). Мы не имеем возможности проводить эксперимент на людях. Мы должны удостовериться, данное вещество на уровне организма не станет неожиданно неспецифически ядовитым. Мы должны удостовериться, данное вещество на животных моделях работает так, как мы ждем,может ли оно способно уничтожать рак, к примеру, на мышиной модели, либо оно стабильно (не разлагается) и т.д.. Лишь после того, как данный рубеж пройден, можно переходить к клиническим исследованиям.
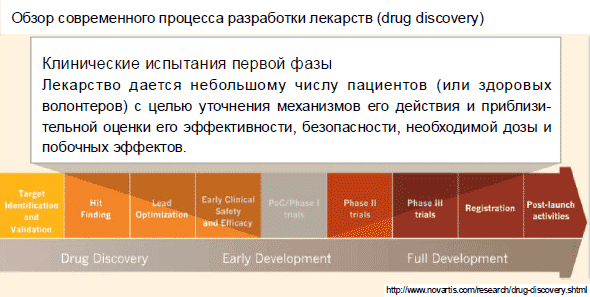
Клинические исследования делятся на 3, а время от времени и на 4 фазы. На 1 фазе вещество, которое вы провели через эти все значения, дается маленькому количеству больных (либо здоровых волонтеров) имея цель уточнения и примерной оценки его производительности, защищенности, достаточной дозы и второстепенных результатов. 10-50 человек. Нередко олонтеры — люди, которые имеют все шансы быть здоровы, просто согласные, дабы на них выяснили действие данного препарата, а вы пытаетесь выяснить на данном рубеже, не классифицируется ли на людях данное вещество ядовитым, не владеет ли оно теми или иными страшными второстепенными результатами. Или еще на данной фазе клинических исследований вещество дается больным, которые, как ни прискорбно, терминально больны, другими словами нет обычных средств и способов у госпиталя, чтоб выручить данного жителя нашей планеты, тогда и человек соглашается на то, чтоб на нем испытали экспериментальный медицинский препарат. Повторюсь, на данном шаге ставится задача не выручить жителя нашей планеты, а удостовериться, что вещество его не уничтожит, — данная миссия 1 фазы клинических исследований.



На 2-ой фазе, как скоро вы удостоверились, собственно вещество владеет ожидаемыми качествами, тестируется большое число больных, около 100-300, и тут теснее отрабатываются какие-либо составные части того, как вещество надо выдавать, в которых порциях, какие у него второстепенные результаты появляются, как их уменьшить и тому подобное. Как скоро данный шаг пройден, переходим к третьей фазе клинических тестирований, как скоро тестируется чрезвычайно большая категория больных — тыс., и тут теснее изучаются различные побочныe результаты, а еще вероятное взаимодействие вашего новейшего продукта с имеющимися, так как нередко как оказалось, собственно композиция 2ух веществ владеет еще наиболее успешным действием, нежели хоть какой из данных веществ отдельно. И лишь после того, как эти все рубежи пройдены удачно, сообразные инстанции различных государств — в Соединенных Штатах Food and Drug Administration (FDA), в РФ Росздравнадзор — получают пакет документов от изготовителя, в каком детализированы все изыскания препараты: от его исследования до преклинических тестирований на животных, до клинических тестирований, и все составные что касается его производства. Практически никаких секретов тут быть не имеет возможности.
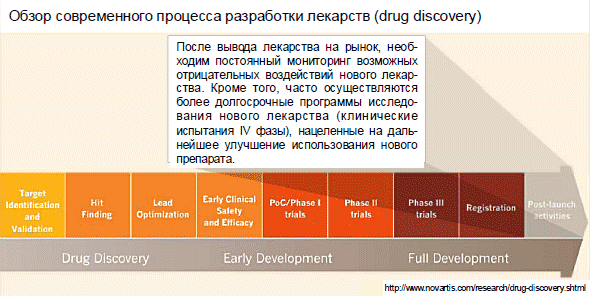
Подходящие инстанции расценивают этот весь пакет документов и решаются, регистрировать данное вещество либо нет. Данное также порой занимает большое количество времени, и потом вещество попадает на рынок, его возможно покупать в аптеке, либо медицинские работники имеют шансы выдавать его больным в клиниках.
Впрочем в том числе и на данном шаге изготовитель продолжает вести прогноз данного препарата. Так как нередко , собственно встают второстепенные результаты, которые видны на продолжительности в пару лет. Как скоро вы провели клинические исследования на протяжении года, все было в норме. Хотя имеет возможность оказаться, собственно явное вещество станет владеть вредным свойством, которое проявится через 5-10 лет после старта его приема.
из лекции Владимира Катанаева
